Las células estromales mesenquimales (MSCs por sus siglas en inglés), o mejor conocidas en español como células madre mesenquimales , definidas por la Sociedad Internacional de Investigación de Células Madre (ISSCR) como células no hematopoyéticas – similares a fibroblastos [1], cada día cobran mayor interés gracias a las importantes capacidades regenerativas y de reparación de tejidos que presentan.
Hasta el 2015, la mayoría de los estudios con MSCs se centraron en el tratamiento de trastornos del sistema musculoesquelético, debido principalmente a su potencial de diferenciación en hueso y cartílago [2]. Sin embargo, cada vez han cobrado mayor interés por sus propiedades inmunomoduladoras, demostradas en estudios clínicos para el tratamiento de diversas patologías, tales como la enfermedad de injerto contra huésped (GVHD por sus siglas en inglés) [3] y enfermedades autoinmunes como el lupus [4, 5] o la enfermedad de Crohn [6]. Además, el potencial clínico de las MSCs se ha ampliado para tratar el infarto de miocardio [7,8], ACV [9], esclerosis múltiple [10,11], cirrosis hepática [12,13], diabetes [14,15] y lesiones pulmonares [16], entre los más importantes.
Las MSCs también se conocen como «fábricas» tróficas debido a la gran cantidad de moléculas bioactivas que secretan en respuesta al entorno local, que luego ejercen sus efectos paracrinos sobre las células y tejidos vecinos.
Secretoma es todo el conjunto de moléculas, principalmente de caracter protéico, secretadas por la célula [17].
Un número creciente de investigadores atribuyen los efectos terapéuticos de las MSCs mayormente a estas propiedades paracrinas, más que a las células directamente, ya que el número de las células en los tejidos es realmente muy bajo respecto a los efectos inmunomoduladores, antiapoptóticos, antifibróticos y angiogénicos, que se observan in vivo [18].
Por otra parte, se sabe que esta acción paracrina está influenciada de forma relevante por el microambiente que rodea las células [19], y es por ello que, in vitro, las condiciones de cultivo, más específicamente los factores presentes en el medio, condiciones de hipoxia, alteraciones de pH o temperatura, número de pasajes (en células expandidas), cultivo 3D bioimpresos o cultivo en esferoides y campos electromagnéticos, entre otros, modulan el secretoma de las células mesenquimales, y en consecuencia su potencial terapéutico [18].
El medio de cultivo enriquecido por el secretoma celular se le conoce como medio condicionado.
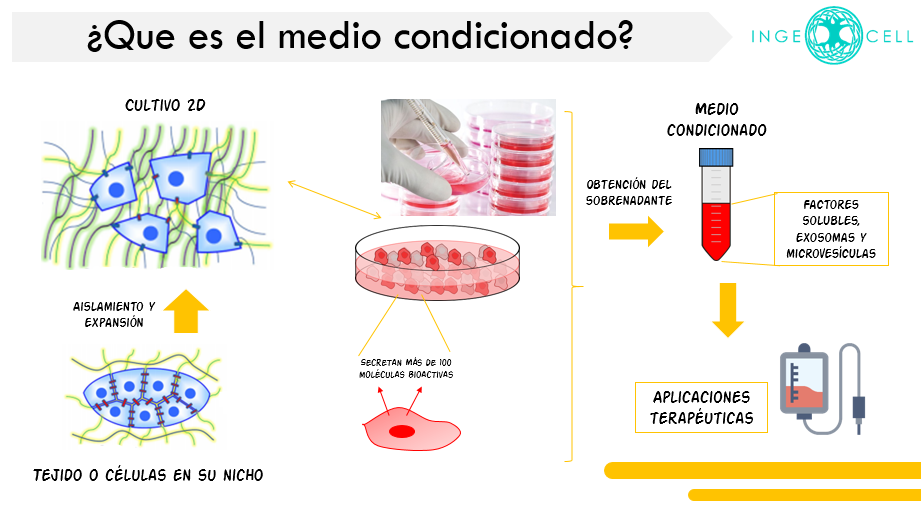
¿Qué elementos componen el medio condicionado?
En el medio encontramos factores solubles y vesículas extracelulares, de las cuales las de mayor interés terapéutico son los exosomas y microvesículas.
Entre los factores solubles, destacan diversos factores de crecimiento y citoquinas como: IL-6, FGF, PDGF, SDF-1, HGF, TGF-beta, TSG-6, LIF, VEGF, GM-CSF, IL-10, VEGF, IL-7, MCP-1, entre muchos otros.
Mientras que los exosomas son vesículas extracelulares de origen endosómico, es decir, vesículas que se ensamblan a nivel del citoplasma de la célula y tienen un tamaño de entre 30 y 100 nanómetros; estas se diferencian de las microvesículas ya que estas últimas se derivan directamente de la membrana plasmática, y presentan tamaños superiores a los exosomas, entre 100-1000 nm.
¿Qué ventajas tiene realizar terapias con medio condicionado en lugar de emplear las células?
Primero, se conoce que el efecto del secretoma supera al tiempo que las células sobreviven tras el trasplante; segundo, las vesículas extracelulares presentes en el secretoma tienen una menor expresión de marcodores de superficie y por ello resultan en una reducida o nula posibilidad de ser inmunogénico, considerando su uso para tratamientos alogénicos [20]; tercero, disponer de un producto listo para usar reduce notablemente el número significativo de células necesarias para el trasplante (aprox. 7.106 células/kg) [21] así como la estabilidad y facilidades de dosificar y comercialización del producto; cuarto, es posible disponer de tasas de producción más altas mediante el uso de condiciones de laboratorio controladas dinámicamente, empleando por ejemplo, biorreactores [22]; quinto, la presentación de “medio condicionado”, una de las opciones de trabajar el secretoma, es más económica y práctica para aplicaciones clínicas, ya que evita los procedimientos invasivos de recolección de células; sexto, obtener un secretoma específicamente dirigido para tratar un determinado tipo de patología, es totalmente viable, interviniendo en las condiciones de cultivo; séptimo, el tiempo y el costo de la expansión y el mantenimiento de las células madre cultivadas podrían reducirse enormemente y las terapias podrían estar disponibles de inmediato para el tratamiento; octavo, el secretoma puede evaluarse de acuerdo a la bioseguridad, dosis y potencia terapéutica, de forma similar a los compuestos farmacéuticos convencionales; y por último, el almacenamiento del producto se puede realizar con seguridad y sin perder potencialidad, descartando el uso de agentes crioprotectores potencialmente tóxicos [20].
En conclusión, el secretoma varía según el tipo celular, el donante del tejido, condiciones de cultivo y otras variables de interés, las cuales se deben tener en consideración para establecer condiciones de manufactura que garanticen la reproducibilidad y calidad terapéutica.
En INGECELL ponemos a su disposición todas nuestras capacidades para asesorarlo y brindarle el mejor acompañamiento en la adquisión o implementación de estas terapias en su práctica diaria. Puede contactarnos por WhatsApp al +57 350 5310687 o escribirnos a info@ingecell.com.
Referencias:
- Ullah et al. 2015. Biosci Rep
- Squillaro Cell Trans. (2016) 25:829–48.
- Christensen et al. Haematologica (2010) 95:2102–10.
- Sun et al. Stem Cells (2009) 27:1421–32.
- Liang et al. Ann Rheum Dis. (2010) 69:1423–9.
- Ciccocioppo et al. Gut (2011) 60:788–98.
- Amado Proc Natl Acad Sci USA. (2005) 102:11474–9.
- Cai et al. Sci Rep. (2016) 6 (28250) .
- Bang et al. Ann Neurol. 57:874–882.
- Mohyeddin Bonab et al. Rep Pilot Study Iran J Immunol. (2007) 4:50–57.
- Karussis et al. Arch Neurol. (2010) 67:1187–1194.
- Kharaziha et al. Eur J Gastroenterol Hepatol. (2009) 21:1199–1205.
- Shi et al. Stem Cells Transl Med. (2012) 1:725–731
- Chang et al Pancreas (2009) 38:275–81.
- Holmes et al Nat Rev Endocrinol. (2014) 10:701
- Kursova et al Bull Exp Biol Med. (2009) 147:542–546
- Ferreira et al. Frontiers in immunology (2018) 9(2837): 1-17
- Caplan AI, Dennis JE. Biochem. (2006) 98: 1076–1084.
- Baraniak PR, McDevitt TC Regenerat Med. (2010) 5:121–43
- Vizoso et al. Int J Mol Sci. (2017) 18: E1852
- Teixeira, F. G., & Salgado, A. J. Neural regeneration research (2020).15(1): 75.
- Teixeira et al . Sci Rep. (2016) 6: 27791.

